藏头诗‖幸有心期当小暑·葛衣纱帽望回车
2023-07-07 09:32:52
更新时间:2024-10-02 10:03:29

化学反应速率是指表示化学反应进行的快慢。通常以单位时间内反应物或生成物浓度的变化(减少值或增加值)来表示,反应速度与反应物的性质和浓度、温度、压力、催化剂等都有关,如果反应在溶液中进行,也与溶剂的性质和用量有关。化学反应速率是一些化学研究与学习的基础,我们需要铭记其中的重要知识点,高考中也有极大考察可能。
一、化学反应速率
1.表示:
用单位时间内c反应物的减少或c生成物的增加来表示。
2.定义式:
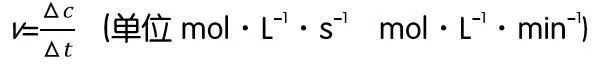
注意事项
☆同一化学反应的反应速率可以用不同物质的浓度变化来表示 ,其数值可能相同,也可能不同,因此表示化学反应速率时要指明具体物质。
☆化学反应速率是一段时间内的平均速率而不是瞬时速率,且无论用反应物还是用生成物表示均取正值。
☆对于固体或纯液体反应物,其浓度视为常数,故不能用固体或纯液体物质表示化学反应速率。用不同物质的浓度变化表示同一化学反应的反应速率时,反应速率的数值之比等于化学方程式中各物质的化学计量之比。
例:mA(g) + nB(g) pC(g) + qD(g)
v (A) ∶v (B) ∶ v (C)∶v (D) =m:n:p:q
二、化学反应速率的基本图像
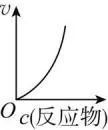
其他反应条件一定,化学反应速率随反应物浓度增大而增大 。
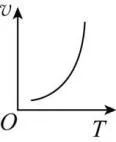
其他反应条件一定,化学反应速率随温度的升高而增大。
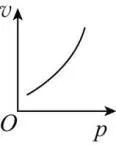
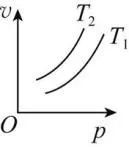
有气体参加的反应,化学反应速率随压强的增大而增大。
有气体参加的反应,化学反应速率随体积的增大而减小。
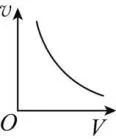
在不同温度下反应,化学反应速率随压强的增大及温度的升高而增大。

三、三段式计算化学反应速率

四、化学反应速率大小的比较方法
方法一:
第一步——统一单位
第二步——换算成同一物质表示的速率,再比较数值的大小。
方法二:
比较化学反应速率与化学计量数的比值。
五、影响化学反应速率的因素
1.内因
反应物本身的性质是影响化学反应速率的决定因素。
如在相同条件下卤素单质与H2反应的速率大小关系
F2 > Cl2 > Br2 > I2
镁、铝、锌、铁与稀硫酸反应的速率大小关系
Mg > Al > Zn > Fe
2.外因
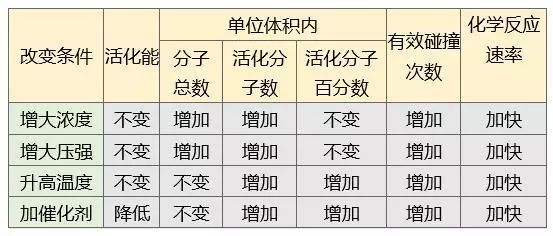
①浓度 —— C↗,V↗
②温度 —— T↗,V↗ (除酶催化反应,T↗,酶活性降低)
③压强 —— P↗导致C↗,V↗ (有气体参与的反应)
④催化剂 —— 正逆反应速率同时增大或减小
⑤其他 —— 固体反应物表面积、光波、电磁波

六、有效碰撞理论——速率的理论解释
1.活化分子——能发生有效碰撞的分子。
2.有效碰撞——活化分子之间能够引发化学反应的碰撞。
3.活化能
E1——正反应的活化能
E2——逆反应的活化能
E3——加入催化剂后正反应的活化能
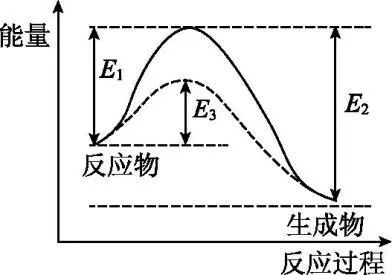
4.活化分子、有效碰撞与反应速率的关

七、充入惰性气体(或不参与反应气体)对反应速率的影响
恒容充惰→总压增大→物质浓度不变(活化分子浓度不变)→反应速率不变
惰性气体→体积增大→物质浓度减小(活化分子浓度减小)→反应速率减慢
(效果等同于体积增大)